Latihan 3. Buatlah 4 soal Pilihan Ganda dari Kelompok anda
a. hanya dapat diberikan untuk unsur periode tiga keatas
b. oktet berkembang dapat terjadi karena adanya hibridisasi orbital s dan p
c. hanya dapat diberikan untuk unsur golongan tiga ke atasd. oktet berkembang dapat terjadi karena hibridisasi dengan orbital de. tidak ada pilihan yang tepat
2. Gambar struktur Lewis senyawa SO2 yang paling tepat adalah … (nomor atom S = 16; O = 8).
a.
b.
c.
d.
e.
3.
Jika entalpi reaksi : CH2 =CH2(g) + HCl (g) → CH3CH2Cl(g) adalah –48 kJ mol–1 , energi ikatan rata-rata C–Cl adalah ....
a. 278 kJ mol–1b. 326 kJ mol–1c. 756 kJ mol–1d. 824 kJ mol–1e. 1648 kJ mol–1
4.
C2H6(g) + Cl2(g) → C2H5Cl(g) + HCl(g)
Nilai entalpi reaksi di atas adalah ....
a. +218 kJ mol–1b. –218 kJ mol–1c. +109 kJ mol–1d. –109 kJ mol–1e. +89 kJ mol–1
Kuis 3. Buatlah 2 soal (Per Chapter) pilihan ganda dari tugas kelompok lain (Chapter 1 s/d 12 (Selain chapter anda))
- CHAPTER 1
1. Setiap unsur mampu membentuk ikatan kimia karena memiliki ….a. Elektron valensi
b. Kecendrungan membentuk konfigurasi electron gas mulia
c. Lintasan electron
d. Neutron dalam inti atom
e. Proton dan neutron
Jawaban : B
Pembahasan:
Unsur-unsur gas mulia sukar bereaksi karena unsur-unsur tersebut tergolong unsur yang stabil. Menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Setiap atom dalam pembentukan senyawa membentuk konfigurasi electron yang stabil, yaitu :
- Konfigurasi electron gas mulia yang disebut konfigurasi octet atau kaidah oktet,
- Sedangkan Helium disebut kaidah duplet.
Atom-atom suatu unsur berusaha mencapai konfigurasi octet atau duplet dengan cara berikatan dengan atom-atom lain.
Ikatan yang terjadi dapat berupa ikatan ion, kovalen dan kovalen koordinasi.
2. Dalam industry pangan, ilmu kimia digunakan untuk meningkatkan mutu pangan. Zat yang dipakai untuk mengawetkan makanan adalah …
a. Benzoat
b. Propionat
c. Ganja
d. Kecap
e. Gula
Jawaban : A
Pembahasan
Zat kimia untuk mengawetkan makanan yang masih diperbolehkan di indonesia adalah :
kalsium benzoat
asam benzoat
sulfur dioksida
kalium nitrit
kalsium propionat
kalsium metasulfat
asam sorbat
- CHAPTER 2
1. Kelemahan teori atom Rutherford adalah tidak adanya penjelasan tentang . . . . .
a. Partikel penyusun inti atom
b. Massa atom berpusat pada inti
c. Electron mengitari inti pada jarak tertentu
d. Inti atom yang bermuatan positif
e. Electron yang memiliki energy tetap
Jawaban : E
Pembahasan :
Rutherford dalam teorinya menjelaskan bahwa :
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh electron yang bermuatan negative.
- Massa atom terpusat pada inti
- Sebagian besar volume atom adalah ruang hampa
- Atom bersifat netral (jumlah proton sama dengan electron)
Kelemahan teori atom Rutherford adalah tidak menjelaskan bahwa electron memilki energy yang tetap.
2. Jika diketahui nuklida
, maka jumlah elektron, proton dan neutron adalah….
a. 23 proton, 12 elektron, 11 neutron
b. 11 proton, 12 elektron, 23 neutron
c. 11 proton, 11 elektron, 12 neutron
d. 11 proton, 12 elektron, 11 neutron
e. 12 proton, 11 elektron, 11 neutron
Jawaban : C
Pembahasan :
Nomor atom = 11
p = 11
e = 11
Nomor massa = 23
p + n = 23
n = 23 – 11 = 12
- CHAPTER 3
1. Berapa gram massa 10 L gas N2 yang memiliki tekanan 110 cmHg dengan 25°C…
a. 5 gr
b. 4 gr
c. 3 gr
d. 2 gr
e. 1 gr
Jawaban : D
Penyelesaian :
2. Diketahui massa atom relatif (Ar) O=16, Al =27 dan S=32. Hitunglah massa molekul relatif Al2(SO4)3.
a.300
b.320
c.344
d.342
e.370
Jawaban:C
Pembahasan
Mr Al2(SO4)3 = (2 x Ar Al) + (3 x Ar S) + (12 x Ar O)
= (2 x 27) + (3 x 32) + (12 x 16)
= 54 + 96 + 192
= 342
- CHAPTER 4
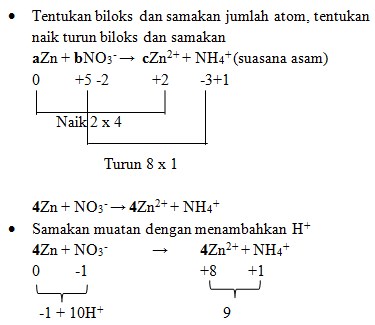
1. Diketahui reaksi :
Jika reaksi diatas disetarakan makan koefisien a, b, dan c berturut-turut adalah . . .
a. 4, 1, 1
b. 4, 1, 2
c. 4, 1, 3
d. 4, 1, 4
e. 4, 1, 5
Jawaban : D
Pembahasan :
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+
- Samakan H dengan menambahkan H2O
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
Maka koefisiennya :
aZn + bNO3‾ → cZn²+ + NH4+
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
2. Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah . . . .
a. 2 – log 4
b. 2 + log 4
c. 2 + log 2
d. 12 + log 4
Jawaban : A
Pembahasan:
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
- CHAPTER 5
1. Suatu gas ideal mula-mula menempati ruang yang volumenya V pada suhu T dan tekanan P. Jika suhu gas menjadi 3/2 T dan tekanannya menjadi 2 P, maka volume gas menjadi ….
a. 3/4 V
b. 4/3 V
c. 3/2 V
d. 3 V
e. 4 V
Jawaban : A
Pembahasan:
2. Sebanyak 3 liter gas Argon bersuhu 27°C pada tekanan 1 atm( 1 atm = 105 Pa) berada di dalam tabung. Jika konstanta gas umum R = 8,314 J mol−1 K−1 dan banyaknya partikel dalam 1 mol gas 6,02 x 1023 partikel, maka banyak partikel gas Argon dalam tabung tersebut adalah…..
a. 0,83 x 10²³ partikel
b. 0,72 x 10²³ partikel
c. 0,42 x 10²³ partikel
d. 0,22 x 10²³ partikel
e. 0,12 x 10²³ partikel
Jawaban : B
Pembahasan:
- CHAPTER 6
1. Perubahan entalpi dari reaksi manakah yang berikut ini dapat disebut dengan perubahan entalpi pembentukan ΔHf° Na2SO4 kristal….
Jawaban : D
Pembahasan:
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
ΔHfo reaksi = ∑ ΔHf° hasil – ∑ΔHf° pereaksi
Reaksi pembentukan ΔHf° Na2SO4
2. Kalor yang dihasilkan pada pembakaran 4,48 Liter gas karbon standar sesuai reaksi sbb adalah….
C(g) + O2(g) → CO2(g) ΔH = -394 kJ/mol
a. – 78,8 kJ
b. + 78.8 kJ
c. +79,2 kJ
d. -79,2 kJ
e. +80,0 kJ
Jawaban : A
Pembahasan :
Mol pembakaran gas karbon = 4,48 L/22,4 Lmol‾¹
= 0,2 mol
ΔH = Q/n
Q = ΔH x n
= -394 kJ/mol x 0,2 mol
Q = -78,8 kJ
- CHAPTER 7
1. Lambang suatu unsur dapat disimpulkan bahwa pada satu atom unsur X mempunyai...
a. 18 neutron dan 18 proton
b. 22 neutron dan 22 proton
c. 40 proton dan 18 elektron
d. 18 proton dan 22 neutron
Jawaban D
Pembahasan :
Nomor atom suatu unsur menunjukkan banyaknya proton atau banyaknya elektron. Sedangkan banyaknya neutron adalah Nomor Massa dikurangi nomor Atomnya.
berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
2. Pada isotop unsur , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
a. (26 , 26) : (88 , 88)
b. (26 , 26) : (88 , 138)
c. (26 , 30) : (88 , 138)
d. (26 , 30) : (88 , 266)
Jawab : C
Pembahasan :
· X = lambang unsur
· Z = jumlah proton
· N = nomor atom
· M = massa atom
· Neutron = A – Z
- CHAPTER 8
1. Tabel data sifat unsur dari Na ke Cl : Perubahan sifat unsur dari Na ke Cl yang benar adalah ….
a. 1 dan 5
b. 2 dan 5
c. 3 dan 6
d. 4 dan 6
Jawab: B
Penyelesaian :
Dalam 1 periode dari kiri ke kanan :
* Energi ionisasi lebih besar
* No atom makin besar
* Jari-jari atom lebih kecil
* No atom makin besar
* Afinitas elektron bertambah besar
* Sifat logam makin berkurang
* Keelektronegatifan bertambah besar
* Titik didih makin tinggi
* Sifat reduktor makin berkurang
* maka Sifat basa makin berkurang
2. Suatu unsur dapat membentuk senyawa ionik dengan rumus X2O3. Data energi ionisasi ke-1 sampai ke-6 (dalam kJ/mol) untuk unsur X adalah .....
a. 500, 4.500, 6.910, 9.540, 13.350, 16.610b. 577, 1.816, 2.744, 11.576, 14.829, 18.375c. 1.090, 2.350, 4.620, 6.220, 37.830, 47.280d. 1.400, 2.860, 4.580, 7.480, 9.400, 53.270e. 1.680, 3.370, 6.050, 8.410, 11,020, 15.160Jawaban: B
Pembahasan :Senyawa ionik X2O3 → X3+ + O2–Karena X stabil setelah melepaskan 3 elektron (ditandai dengan muatan 3+ saat membentuk senyawa) maka untuk melepaskan elektron keempat energi ionisasinya menjadi sangat besar, melonjak, naik drastis, dari energi ionisasi ketiga ke energi ionisasi keempat.
- CHAPTER 10
1. CH4 mempunyai struktur tetrahedral, dengan empat buah domain elektron ikatan pada empat arah yang sama. Maka bentuk hibridisasi yang terjadi pada CH4 adalah ….
a. sp
b. sp3
c. sp3d2
d. sp2
Jawaban : B
Pembahasan :
Konfigurasi elektron atom 6C = 1s2 2s2 sp2
Empat elektron yang tidak berpasangan pada konfigurasi elektron C terhibridisasi akan berpasangan dengan elektron dari atom H sehingga membentuk orbital hibrid sp3 (tetrahedral).
2. Tentukan tipe molekul dari BF3…..
a. AX3
b. AX2
c. AX4E
d. AX4
e. AX2E
Jawaban : A
Pembahasan:
- BF3 jumlah electron valensi atom pusat atau Boron(B)= 5
- Jumlah pasangan electron ikatan (x)= 4
- Jumlah pasangan electron bebas E= 0
- Tipe molekul AX3
- CHAPTER 11
1. Gaya dispersi pada molekul-molekul non-polar terjadi akibat adanya ….
a. Dipol-dipol permanen
b. Dipol-dipol sesaat
c. Imbasan dipol poermanen
d. Gaya elektrostatis molekul polar
e. Ikatan hidrogen
Jawaban: B
2. Berdasar data berikut manakah yang mengindikasikan memiliki gaya interaksi terkuat?
Zat ΔHvap (kJ/mol) Argon (Ar) 6,3 Benzena (C6H6) 31,0 Etanol (C2H5OH) 39,3 Air (H2O) 40,8 Metana (CH4) 9,2
- Argon
- Benzena
- Etanol
- Air
- Metana
Pembahasan:
Menguap sama artinya mengubah partikel cair menjadi gas. Untuk menjadi gas dari cairan maka partikel-partikel yang berinteraksi harus memisahkan diri. Energi penguapan (∆Hvaporation) menunjukkan besar energi yang diperlukan untuk memutuskan interaksi antarpartikel. Semakin kuat interaksi atau gaya tarik-menarik antarpartikel maka dibutuhkan energi penguapan lebih besar. Jadi gaya interaksi terkuat pada soal ini adalah Air dengan ∆Hvaporation terbesar.
- CHAPTER 12
1. Jika didalam suatu larutan yang dibuat dengan melarutkan 5,5 gram glukosa (C6H12O6) dalam 200 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,14 molal
c. 0,35 molal
d. 0,05 molal
e. 0,15 molal
Jawaban : E
Pembahasan :
Mr C6H12O6 = 18
2. Jika didalam zat terlarut dan zat pelarut ada 200 gram air dan dilarutkan 30 gram asam cuka (CH3COOH) fraksi molnya zat terlarut adalah (Ar C = 12, H= 1, O = 16) ….
a. 0,943
b. 0,957
c. 0,987
d. 0,945
e. 0,975
Jawaban : B
Pembahasan :
Mr CH3COOH = 60
M r H2O = 18




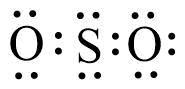




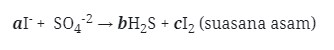


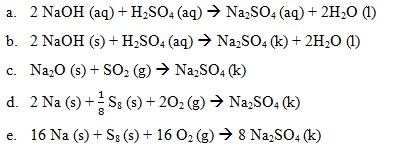
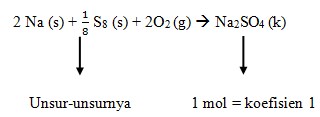



Tidak ada komentar:
Posting Komentar